テクニカルインフォメーション
電気泳動ゲルのタンパク質の染色
キャンペーン期間中、対象製品をお買い得価格でご購入いただけます。詳細は下記画像をクリックしてキャンペーンカタログをご覧ください。
電気泳動はタンパク質固有の電荷や分子量の違いを利用して、電気で各分子を分離する手法です。一般的にアクリルアミドなどから成る透明のゲルを使ってタンパク質のバンドを分離しますが、そのままではバンドを確認することはできません。そこで、クーマジーブリリアントブルーなどの色素染色や、写真現像の原理を応用した銀染色などによりバンドを視覚化し、分子量の概算や発現量の比較などを行います。 今回はアトーの製品を使用したゲル染色に関してご紹介します。
クーマジーブリリアントブルー(CBB)染色
CBB 染色は安価で簡便な方法であり、定量的に染色されるため、もっともよく使用されるゲル染色法の一つです。検出限界は 10 ~ 100ng/ バンドです。染色原理は色素とタンパク質のアミノ基が電気的に結合したり、非共有的にファンデルワールス力により相互作用することによるといわれています。アトーの EzStain AQua はアルコールや酢酸を使用せず、脱色には蒸留水が使用できるため、簡便なうえに環境に配慮した染色方法です。検出感度も一般的な CBB 染色法と比べて 3 ~ 5 倍高く、バンド以外の部分が染色されにくいため、短時間でバンドを確認することができます。
実験方法
実験材料・機器など
電気泳動後のゲル、EzStain AQua(AE-1340)、蒸留水、容器、電子レンジなど
1.電気泳動

EzStain AQuaで染色する場合は、目的タンパク質のバンドが数十ng以上になるように、アプライするタンパク質量を調製します。電気泳動後のゲルは放置せず、直ちに染色液に浸漬します。低分子を染色する場合は固定液(40% メタノール、10% 酢酸溶液)で30分以上固定してしてください。
2.ゲルの染色
![]()
EzStain AQuaをゲルサイズよりも大きいタッパーに注ぎ、電気泳動後のゲルを溶液に浸漬します(~50mL/ゲル)。 室温で3時間以上染色します。
※迅速染色する場合は、電子レンジで30~60秒(40℃くらいになるまで)温めます。室温で30分以上染色します。
3.ゲルの脱色
![]()
EzStain AQuaを廃棄し、蒸留水で2回すすぎます。新たに十分量の蒸留水を添加して脱色します(~100mL/ゲル)。
※迅速脱色する場合は、電子レンジで30~60秒(40℃くらいになるまで)温めます。室温で30分以上脱色します。
一般的なCBB染色の試薬の組成
より再現性良く、簡便に実験を行う際はアトーのゲル染色試薬をご利用ください。
- 染色液:0.25% Coomassie Brilliant Blue, 40%メタノール, 7% 酢酸
- 脱色液: 40% メタノール、7%酢酸
1.電気泳動後のゲルを染色液に浸漬し、4時間以上(~O/N)インキュベーションする。
2.脱色液に置換し、数回交換しながら脱色する。
銀染色
銀染色法は呈色法では最も感度よくタンパク質を染色する方法です。一般的に検出限界は100pg~1ng/バンドです。検出感度は優れていますが、ゲル表面のタンパク質だけが染色されるうえに、すぐに染色が飽和するため定量性が乏しいといわれています。タンパク質の固定にグルタルアルデヒドを使用すると、染色途中でタンパク質が修飾されてしまうため、質量分析等には適しません。アトーのEzStain Silverは試薬調製が容易なうえに、約1時間で染色操作が終了する迅速で簡便な方法です。DNAの染色にも使用でき、もちろん質量分析にも適した染色方法です。
実験方法
実験材料・機器など
電気泳動後のゲル、EzStain Silver(AE-1360)、メタノール、酢酸、蒸留水、マイクロピペット、メスシリンダー、容器など
1.試薬の調製

下記4種類の試薬を調製します(即時調製)。S-1~4溶液はEzStain Silverの試薬です。発色液は200mL、それ以外は100mL必要です。
・固定液:1% S-1溶液、50% メタノール、10% 酢酸
・染色液:1% S-2溶液
・発色液:1% S-3溶液、1% S-4溶液
・停止液:1% 酢酸
3.ゲルの洗浄
![]()
固定液を廃棄し蒸留水で10分間×2回、洗浄します。
※サンプルバッファーにDTTが添加されている場合は、蒸留水の代わりに30%メタノール溶液で洗浄します。
4.ゲルの染色
![]()
蒸留水でさらに10分間洗浄した後、染色液を添加し、5分間インキュベーションします。
※染色液は重金属廃液として処理してください。ゲルが厚い場合は時間を延長します。
5.ゲルの発色
![]()
蒸留水で軽くリンスした後に、発色液を半量添加して30秒間インキュベーションします。発色液を廃棄し、残りの発色液に置換して、発色されるまでインキュベーションします。十分発色されたら停止液を添加して10分間インキュベーションし、発色を停止します。その後、蒸留水に置換します。
一般的な銀染色の試薬の組成
より再現性良く、簡便に実験を行う際はアトーのゲル染色試薬をご利用ください。
Blum et al. (1987) Electrophoresis 8, 93-99.より
- 固定液:40%メタノール, 10% 酢酸
- 洗浄液:30% エタノール
- 前処理液:0.02% チオ硫酸ナトリウム
- 染色液:0.1% 硝酸銀
- 発色液:3%炭酸ナトリウム、0.05% ホルムアルデヒド
- 停止液:3% 酢酸
1.電気泳動後のゲルを固定液に浸漬して1時間以上インキュベーションする。
2.洗浄液で20分間×2回洗浄する。
3.蒸留水で20分間洗浄する。
4.前処理用液で1分間インキュベーションする。
5.染色液で20分間インキュベーションする。
6.蒸留水で20秒間×3回洗浄する。
7.発色液で3∼5分間インキュベーションする。
8.蒸留水で洗浄した後に、停止液で5分間インキュベーションする。
リバース(ネガティブ)染色
リバース染色法はタンパク質のバンドは透明なままで、バンド以外のゲル部分(バックグランド)が白く染色される検出方法です。検出限界は1 ~10ng/バンドです。ゲル内のSDSなどの塩と染色液中の金属イオンが結合して沈殿するため、タンパク質バンド以外の部分が白濁します。タンパク質自体は染色の影響をほぼ受けません。アトーのEzStain Reverseは試薬調製が容易なうえに、約30分間で染色操作が終了する迅速で簡便な方法です。DNAの染色にも使用でき、もちろん質量分析にも適した染色方法です。
実験方法
実験材料・機器など
電気泳動後のゲル、EzStain Reverse(AE-1310)、メタノール、蒸留水、メスシリンダー、容器など
1.試薬調製

下記3種類の試薬を調製します(即時調製)。
・前処理液:10% メタノール/100mL
・染色液:10mL R-1溶液+50mL蒸留水
・発色液:10mL R-2溶液+50mL蒸留水
※R-1、R-2溶液はEzStain Reverseの試薬です。
2.ゲルの前処理
![]()
電気泳動後のゲルを前処理液に浸漬し、5分間インキュベーションします。
3.ゲルの染色
![]()
蒸留水で30秒間洗浄した後に、染色液を添加し、10∼15分間インキュベーションします。
※染色液は重金属廃液として処理してください。ゲル濃度が高い場合は染色時間を延長します。
4.ゲルの発色
![]()
蒸留水で30秒間洗浄した後に、発色液を添加して1∼3分間インキュベーションします。
※黒い紙の上などで発色するとバンドが見やすくなります。
5.染色の停止
![]()
発色液を廃棄し、蒸留水を添加して2分間×2回インキュベーションし、発色を停止します。
一般的なリバース染色の試薬の組成
より再現性良く、簡便に実験を行う際はアトーのゲル染色試薬をご利用ください。
Ortiz, M. L. et al. (1992) FEBS Vol. 296, 300~304より
- 染色液:0.2 Mイミダゾール、0.1%SDS
- 発色液:0.3 M 硫酸亜鉛
1.電気泳動後のゲルを染色液に浸漬し、15分間インキュベーションする。
2.発色液に置換し、30∼45秒間インキュベーションする。
参考データ
実験例1:CBB染色法の比較

上図はヒトトランスフェリンタンパク質を400ng/レーンからの1/2希釈系列で泳動し、EzStain AQuaおよび一般的なCBB染色でゲルを染色した結果です。
EzStain AQuaは電子レンジを使用すると、約10分でバンドが確認できるようになり(A)、一晩染色してもバンド以外の部分が染色されないため、脱色なしでバンドを確認できます(B)。
さらに脱色後は一般的なCBB染色法の検出限界が25ng/レーン(F)なのに対し、その約1/4の6.2ng/レーン(C)まで検出することができます。
一方、一般的なCBB染色法は染色後10分ではバンドが確認できず(D)、一晩染色するとバンド以外の部分も一様に呈色されるため、やはりバンドを確認できません(E)。
このようにEzStain AQuaは、簡便な使用方法である上に、迅速にかつ感度よくバンドを検出できるエコロジーなCBB染色液です。
実験例2:染色法の比較
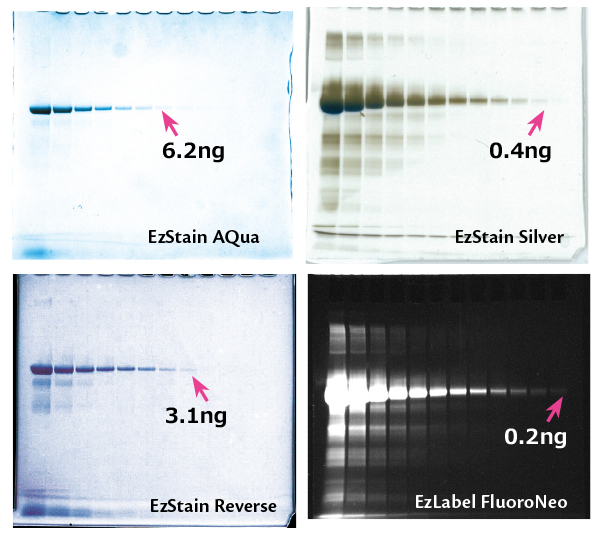
上図はヒトトランスフェリンタンパク質を400ng/レーンからの1/2希釈系列で泳動し、アトーのゲル染色試薬で染色した結果です。
EzLabel FloroNeoはサンプル調製時に蛍光標識しており、ゲル染色はしていません。このようにゲルの染色方法により、検出感度が異なります。