テクニカルインフォメーション
ウエスタンブロッティング ブロッキング
キャンペーン期間中、対象製品をお買い得価格でご購入いただけます。詳細は下記画像をクリックしてキャンペーンカタログをご覧ください。
ウェスタンブロッティングのPVDF膜(メンブレン)などはタンパク質が結合しやすい素材です。ブロッキングは転写されたタンパク質バンドがない膜表面に抗体や検出用の酵素、他のタンパク質などが非特異的に結合するのを防ぎます。ブロッキング剤の選択により検出感度やバックグランドの出方は大きく影響されるため、実験結果が全く変わったものになります。今回はアトーの製品を使用したウェスタンブロッティングのブロッキングの特徴に関してご紹介します。
実験の流れ
1.サンプル調製
細胞や組織などからRIPA Lysisバッファー やSDSサンプルバッファーでタンパク質を抽出し、SDS処理および還元処理を行います。
使用する製品
タンパク質抽出処理液
(EzRIPA Lysis kit, EzApply, EzLabel FluoroNeo)
ブロックインキュベータ
(MyMiniBLOCK, PowerBLOCK)
3.トランスファー
電気泳動後、分離したタンパク質をゲルからPVDF膜に転写します。
使用する製品
トランスファーバッファー
(EzFastBlot HMW)
トランスファーパック
(QBlot kitシリーズ)
ブロッターパワーサプライ
( HorizeBLOT)
実験方法
電気泳動
目的タンパク質の分子量が分離できるアクリルアミド濃度のゲルを使用し、電気泳動をします。
高分子の場合… |
低分子の場合… |
||
|---|---|---|---|
| できるだけ低濃度のアクリルアミドを使用します。7.5%以下の濃度のアクリルアミドゲルは取り扱いが難しいため、その場合は濃度勾配ゲルを使用します。 | 一般的には高濃度のアクリルアミドゲルを使用しますが、転写効率が著しく下がります。電気泳動バッファーEzRun MOPSを使用すると、10%前後のアクリルアミドゲルでも低分子側のバンドが分離でき、且つアクリルアミド濃度が均一のため、ブロッティング前後でのゲルの変形も防ぐとともに、高効率に転写することが可能になります。 |
トランスファー
目的タンパク質の転写に適した転写バッファーと方法を選択します。
高分子の場合… |
低分子の場合… |
||
|---|---|---|---|
| 150kDa以上の高分子は転写効率が著しく悪いため、高分子専用のトランスファーバッファーであるEzFastBlot HMWを用いたセミドライブロッティング、もしくはタンク式ブロッターを使用します。また転写前にゲルをトランスファーバッファーで平衡化(約30分間)するとタンパク質の転写効率が上がる場合があります。ただし平衡化の時間が長くなると低分子バンドが消失したりバンドが拡散するので注意が必要です。 | 低分子タンパク質(~200kDa)を転写する場合、EzFastBlotを使用すると約10分間の短時間で、高効率に転写することができます。QBlot kitシリーズは、ブロッティング膜やブロッティングバッフアーの調製が不要なので、作業時間をさらに短縮でき、より高効率に転写することが可能です(最短5~10分の転写時間)。低分子の場合、ブロッティング膜から抜ける場合がありますので、ポアサイズが0.2μmのPVDF膜(P plus膜)を使用します。またトランスファーバッファーにメタノールを添加すると膜への吸着がよくなります(EzFastBlotシリーズにはメタノールを添加しないでください)。 |
ブロッキングの準備
電気泳動からブロッティングを行っている間にブロッキングの準備をします。
ブロッキング溶液
ミニゲル1枚当たり50mL準備します。下表を参照して目的分子の検出法などからブロッキング溶液を選択します。
| ブロッキング剤 | スキムミルク | EzBlock Chemi | EzBlock BSA | EzBlock CAS |
|---|---|---|---|---|
| 型式 | ― | AE-1475 | AE-1476 | AE-1477 |
| 主成分 | 牛スキムミルク | 合成ポリマー | 牛アルブミン | 牛カゼイン |
| 反応時間 | 30~60min | 5~60min | 15~60min | 15~60min |
| アビジンービオチン | NG | OK | OK | NG |
| リン酸化タンパク質 | NG | OK | OK | NG |
※EzBlock Chemi/EzBlock BSA/EzBlock CASは蒸留水で5倍希釈して使用します。EzBlock BSA/EzBlock CASは試薬に添付されたTween20も1/100量添加します。
※スキムミルクは1~5%濃度でTBS-TあるいはPBS-Tに溶解してブロッキング溶液としています(推奨ではありません)。
洗浄液
ミニゲル1枚当たり500mL準備します。
| TBS-T | PBS-T | ||
|---|---|---|---|
| EzTween(あるいは0.01~0.1%Tween 20)含有1×EzTBS (あるいは50 mM Tris, 137 mM NaCl, 2.7 mM KCl/pH7.4) | EzTween(あるいは0.01~0.1%Tween 20)含有1×EzPBS (あるいは137 mM NaCl, 2.7 mM KCl, 81 mM Na2HPO4, 14.7 mM KH2PO4 ※リン酸化タンパク質を検出する際は、なるべくTBS-Tを使用します。 |
抗体
一般的にターゲットタンパク質に対する1次抗体と検出用の酵素や蛍光が標識された2次抗体を準備します。
1次抗体が直接標識されている場合は2次抗体は不要です。
抗体の希釈率は抗体や検出試薬の添付文書を参考にして決めます。
サンプルや時間に余裕がある場合は、ドットブロッティングで適切な抗原の検出感度になるように希釈率を検討します。
また抗体の希釈は抗体反応の直前に行います。抗体を希釈した状態で長時間置くと失活する場合があります。
ブロッキング方法
下記に従って、膜のブロッキング処理をします。
1.ブロッティング

ブロッティング終了後、ブロッターのふたを外し、ゲルとブロッティング膜を回収します。
2.≪オプション≫ ゲルの染色

転写ムラや転写効率を調べるために、転写後ゲルに残っているバンドをCBB染色液で染色します。
3.膜の洗浄
 ブロッティング膜をTBS-T/PBS-Tに浸漬し、20~30秒間軽く洗浄します。
ブロッティング膜をTBS-T/PBS-Tに浸漬し、20~30秒間軽く洗浄します。
※洗浄後のブロッティング膜は、風乾後、密閉して-20℃で保存できます。
4.ブロッキング
 ブロッティング膜をブロッキング溶液に浸漬し、室温で~30分間浸透しながらインキュベーションします。
ブロッティング膜をブロッキング溶液に浸漬し、室温で~30分間浸透しながらインキュベーションします。
※ブロッキング時間が長くなるとオーバーブロックになり、検出感度が悪くなります。
逆に短すぎると十分にブロッキングされず、バックグランドが上がったり、非特異的バンドが出現する要因になります。
5.抗体反応
 ブロッキング終了後、希釈した抗体溶液に浸漬します。
ブロッキング終了後、希釈した抗体溶液に浸漬します。
参考データ
実験例1:ブロッキングバッファーによる違い
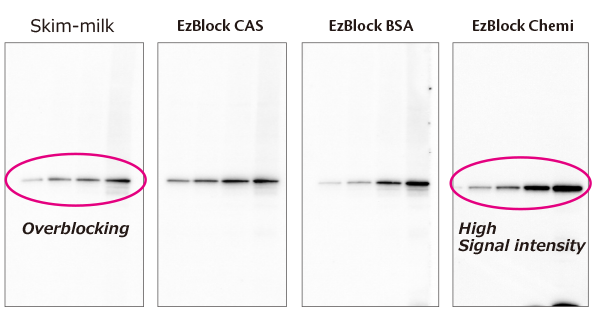
上図はブロッキング剤による違いが(左から3%スキムミルク/TBS-T、EzBlock CAS、EzBlock BSA、EzBlock Chemi)実験結果に与える影響を検討した結果を示しています。
Hela細胞抽出液を段階希釈して電気泳動し、EzFastBlotでP plus膜に転写後、それぞれのブロッキング剤で30分間ブロッキング処理を行なった後、
SMAD2タンパク質に対する抗体で抗体反応を行い、EzWestLumi plusで検出しました。
スキムミルクを使用した場合、シグナルが弱くなり、低濃度のバンドが検出しにくくなります(オーバーブロッキング)。
EzBlock CASは主成分がスキムミルクのブロッキングに寄与するタンパク質でもあるカゼインから成りますが、
精製カゼインタンパク質を使用しているため、低濃度のバンドもマスキングされずに検出できます。
一方、EzBlock Chemiは主成分がタンパク質ではなく合成ポリマーから成りますが、バックグランドを抑え、非特異的なバンドの出現もなく、
マスキングされずにタンパク質濃度に比例したシグナルを検出できることを示しています。このように、ブロッキング剤はバンドの検出感度や強度に大きな影響を与えることが判ります。
実験例2:ブロッキング時間による違い
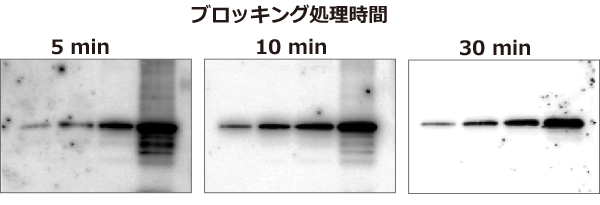
上図はブロッキングの処理時間(左から5分間、10分間、30分間のインキュベーション時間)が実験結果に与える影響を検討した結果を示しています。
Hela細胞抽出液を段階希釈して電気泳動し、EzFastBlotでEzFastBlotに転写後、それぞれEzBlock Chemiで5~30分間ブロッキング処理を行なった後、
SMAD2タンパク質に対する抗体で抗体反応を行い、EzWestLumi plusで検出しました。
ブロッキング時間が5分間と短いとバックグランドが高く、非特異的なバンドが検出されますが、適正な時間行えばバックグランドを低く抑えられ、且つ各バンドを明瞭に検出できます。
EzBlock Chemiを使用した場合、ブロッキング力が強いため上記の結果のように10分間のブロッキング時間でも十分なブロッキング効果が得られます。
もちろん30分間ブロッキング処理を行った方が、非特異的なバンドが検出されず、バックグランドも抑えられますが、低濃度のタンパク質バンドはシグナル強度が若干弱くなります。
しかしこれらの結果は、一概にブロッキング時間の影響だけでは説明できず、ブロッキング剤と膜およびサンプルによって左右されます。
いずれにしても、ブロッキング時間はバンドの検出感度や強度に大きな影響を与えることが判ります。
実験例3:抗体剥離とブロッキング剤
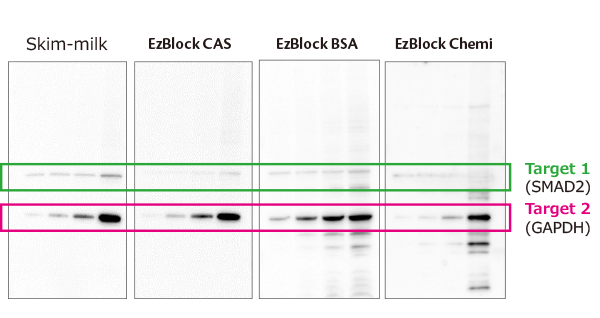
上図はEzReprobeにより最初の検出で使用した抗体を剥離した後に、様々なブロッキング剤により(左から3%スキムミルク/TBS-T、EzBlock CAS、EzBlock BSA、EzBlock Chemi)再ブロッキングした際に、実験結果にどのような影響を与えるかを検討した結果です。
Hela細胞抽出液を段階希釈して電気泳動し、EzFastBlotでP plus膜に転写後、EzBlock Chemiで30分間ブロッキング処理を行なった後、
SMAD2タンパク質に対する抗体で抗体反応を行い、EzWestLumi plusで検出しました。
EzReprobeと10分間インキュベーションして抗体を剥離し、再度上記のブロッキング剤でブロッキングを行いました。
その後GAPDHに対する抗体と反応して、最終的に得たシグナルをEzWestLumi plusで検出した結果を上図は示しています。
上記の結果のように、スキムミルクを使用した際はTarget 1の非特異的シグナルが除けず、EzBlock BSAを使用した場合は、非特異的バンドが検出される結果となりました。
一方、EzBlock CASを使用すると、非特異的ハンドの出現が抑えられ、2回目の抗体反応によるシグナル(Target 2)が十分なシグナル強度で検出できます。
このように、抗体剥離後のリプロービング前に行うブロッキングには、EzBlock CASを使用すると非特異的バンドの出現やバックグランドを抑えられ、きれいな結果を得ることができます。
実験例4:抗体剥離とブロッキング時間
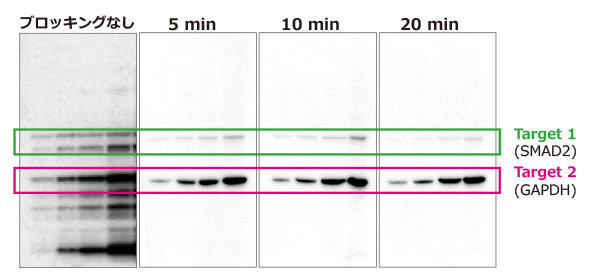
上図はEzReprobeにより最初の検出で使用した抗体を剥離した後に再ブロッキングする際、ブロッキング時間によって実験結果にどのような影響を与えるかを検討した結果です。
Hela細胞抽出液を段階希釈して電気泳動し、EzFastBlotでP plus膜に転写後、EzBlock Chemiで30分間ブロッキング処理を行なった後、
SMAD2タンパク質に対する抗体で抗体反応を行い、EzWestLumi plusで検出しました。
EzReprobeと10分間インキュベーションして抗体を剥離し、再度EzBlock CASで5分間、10分間、20分間インキュベーションして再ブロッキングを行いました(ブロッキングなし:再ブロッキングをせずに抗体反応を行った)。
その後GAPDHに対する抗体と反応して、最終的に得たシグナルをEzWestLumi plusで検出した結果を上図は示しています。
上記の結果のように、再ブロッキングをしない場合は非特異的バンドの出現が顕著になります。
逆に再ブロッキングの時間は5分間でも十分な効果が得られ、時間を20分間まで伸ばすことにより、
リプロービングしたTarget 2のシグナル強度は維持したまま、剥離した抗体(Target 1) の残存シグナルが弱くなり、きれいな結果が得られることが示されました。
このように、抗体剥離後のリプロービング前に行うブロッキングは必須であり、短時間のブロッキング処理でも十分な効果が得られることが判ります。