WSE-7066 EzRun MOPS non-SDS

核酸/タンパク質のNative-PAGE用の泳動バッファー
核酸およびタンパク質を、アクリルアミドゲルもしくはアガロースゲルで分離するときに使用できる 20×Tris-MOPS-EDTA溶液です。低分子側の分離範囲が広がるため、10bp~分離可能です。核酸のアガロースゲルの緩衝液としても使用できます。
| 製品名 | WSE-7066 EzRun MOPS non-SDS |
|---|---|
| コード | 2332306 |
| 価格 | ¥12,800 |
製品概要
- ポリアクリルアミドゲル(PAG)による核酸の分離で使用するMOPS系泳動バッファー
- 核酸用アガロースゲル作製/泳動用バッファーとしても使用可能
- バッファーを本製品に変えるだけで低分子側の分離範囲が拡大(10bp~)
- タンパク質のNative PAGE/BN PAGEに使用するMOPS系泳動バッファー
- Bis-Tris系ゲルのタンパク質のNative PAGE/BN PAGEでも使用可能
- 泳動時間が短縮可能
- 滅菌済で 室温1年安定
- 使い易い少量タイプ
データ・資料
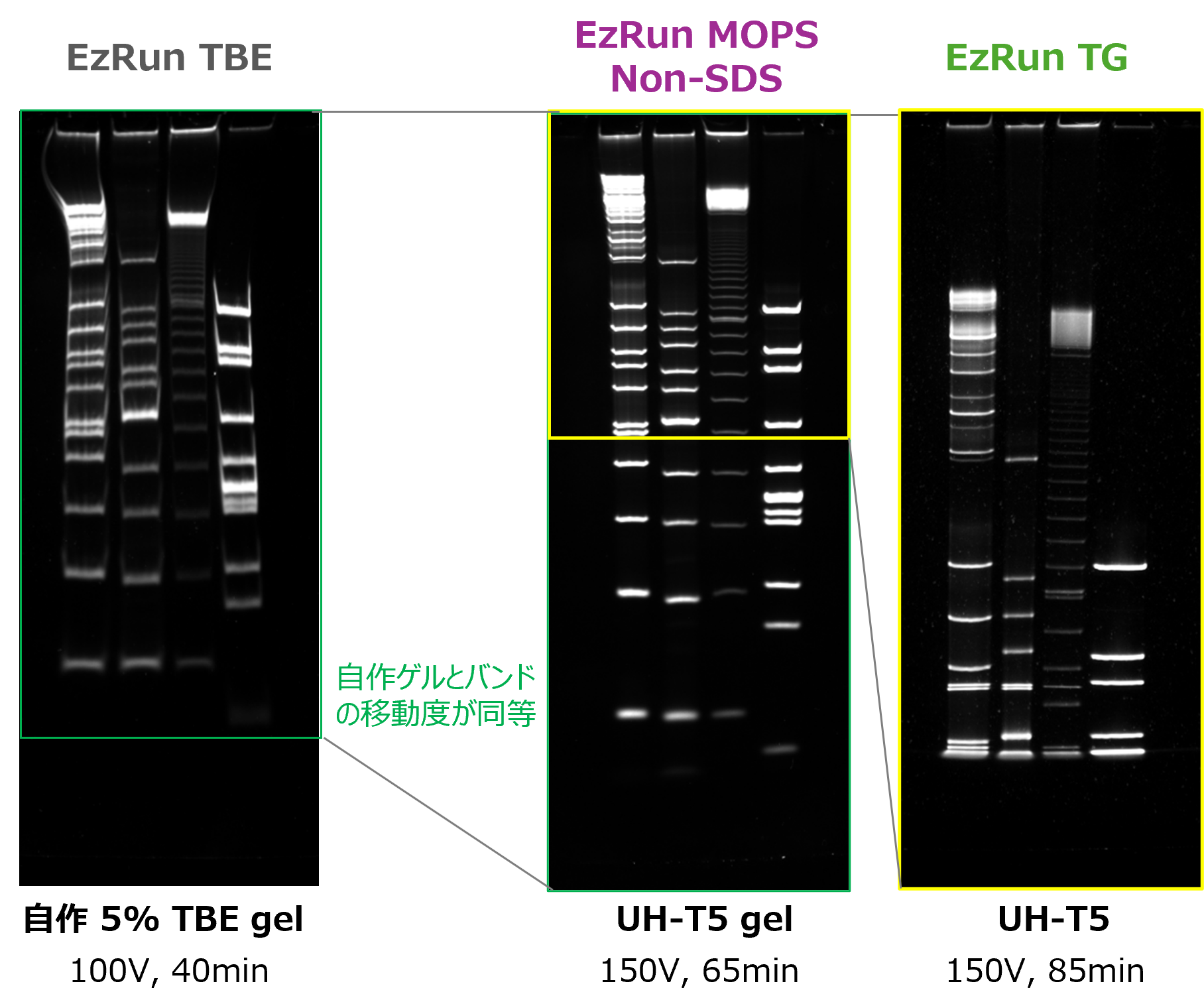
泳動バッファーの違い EzRun MOPS non-SDS vs EzRun TG

左図は、自作のTBEゲルと同じ濃度の既製ゲルを使用し、泳動バッファーの違いによるDNAの泳動パターンや移動度の違いを比較したものです。低分子側の分離にはWSE-7066 EzRun MOPS non-SDS(左) が、高分子側の分離にはWSE-7055 EzRun TG(右)が適していることが示されました。このように泳動バッファーを使い分けることで、 同じ濃度のポリアクリルアミドゲルでも分離範囲を変えることが可能です。
ゲル濃度および泳動バッファーの違いによるバンドの移動度
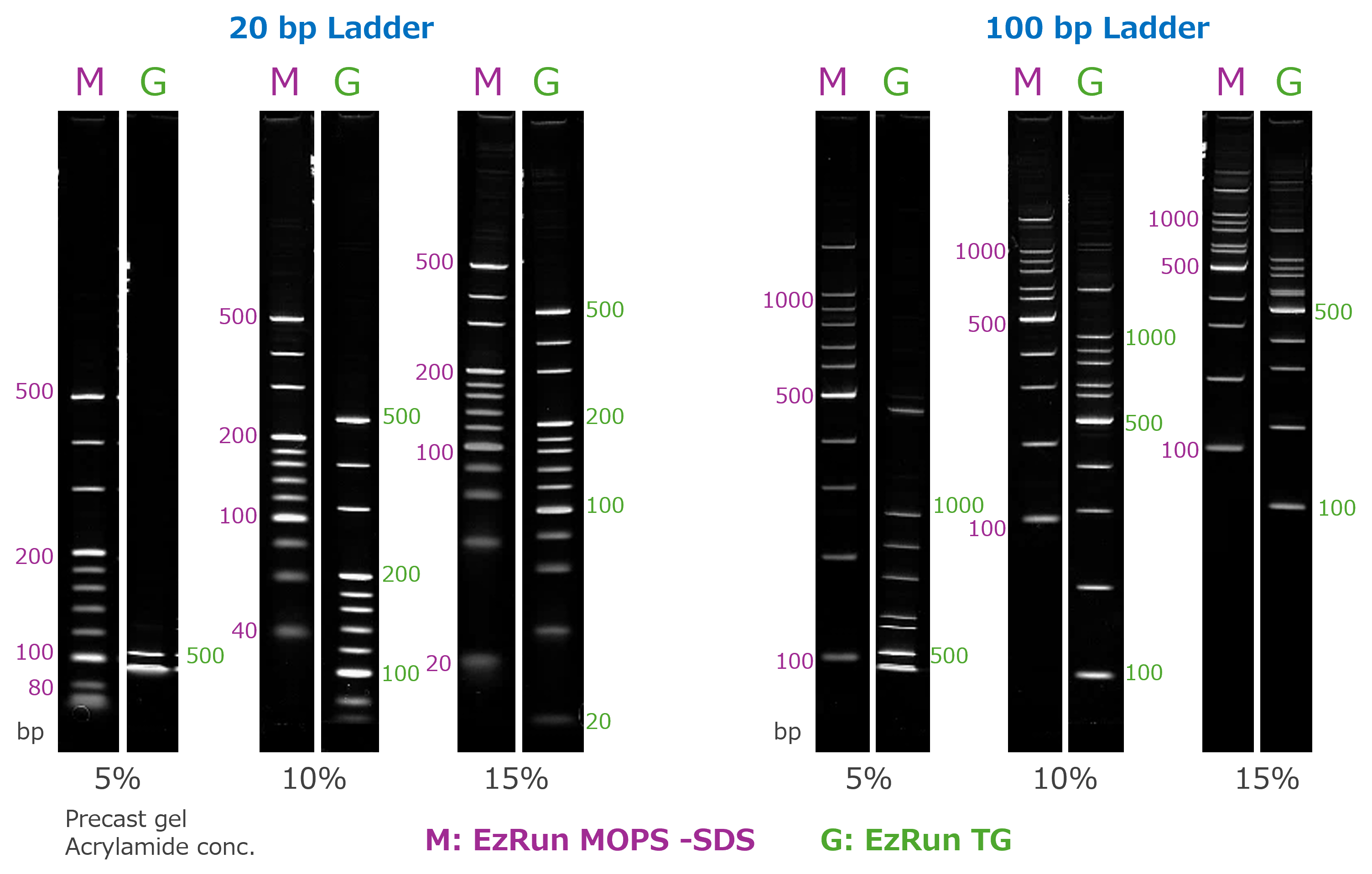
左図は5%、10%、15%のポリアクリルアミドゲル(e-PAGEL)を使用し、20 bp DNAラダー(左)および 100 bp DNAラダー(右)を分離した結果を示しています。泳動バッファーには、WSE-7066 EzRun MOPS non-SDS (M)あるいはWSE-7055 EzRun TG(G)を使用しました。泳動後のゲルの染色はWSE-7130 EzFluoroStain DNAを使用し、CyanoViewで励起してWSE-5400 Printgraph Classicで撮影しました。
このように、 WSE-7066 EzRun MOPS non-SDSはWSE-7055 EzRun TG で泳動するよりも移動度が小さくなることが示されました。同一濃度の既製ゲルを使用しても、バッファーをWSE-7066 EzRun MOPS non-SDSに変更すれば、低分子側の分離範囲を広げられることがわかります。
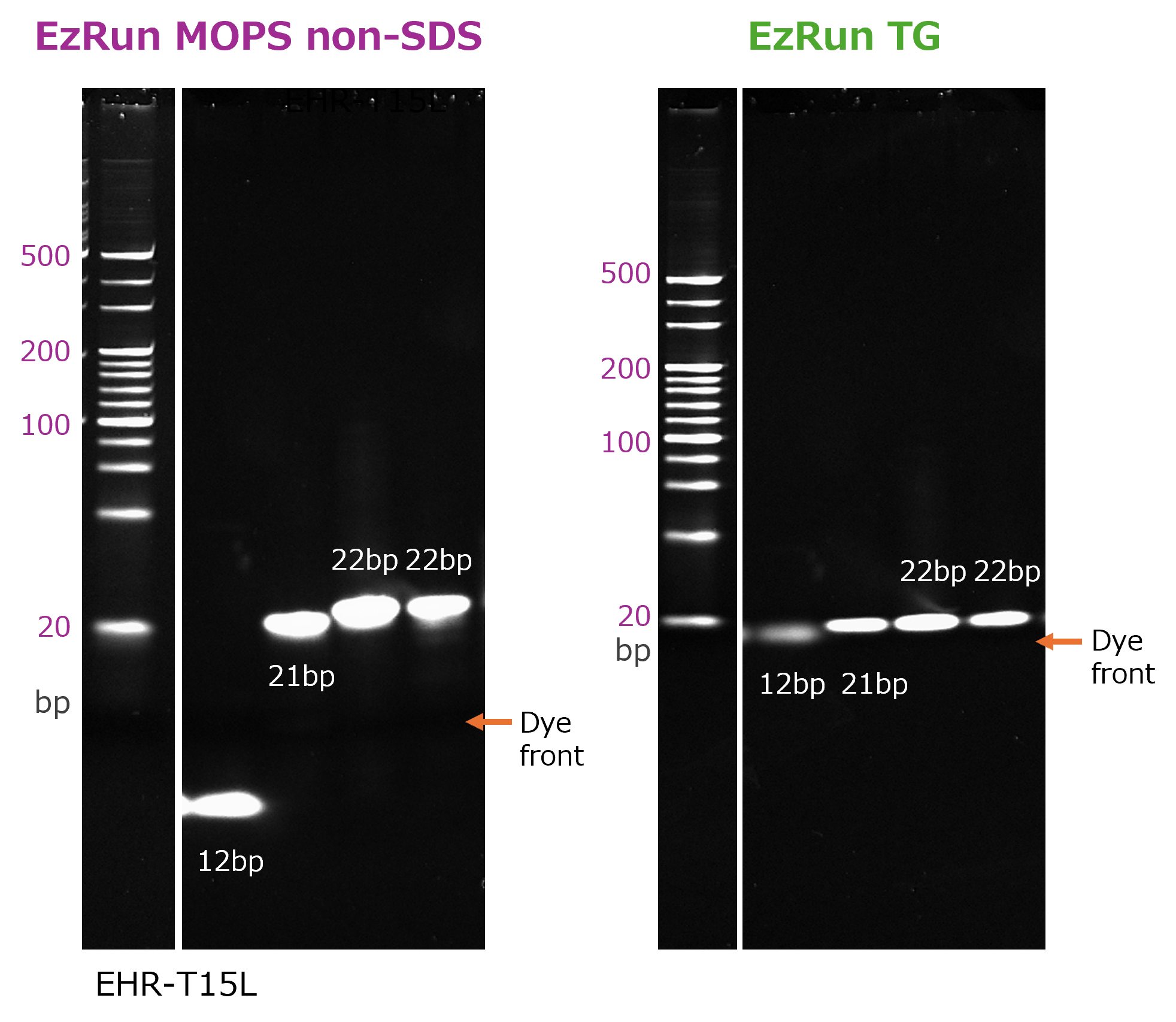
10~20 bpのDNA断片の分離に最適!

左図は、左から20 bp DNAラダー、それぞれ表示された大きさのDNA断片(2種類の22 bpバンドは配列違い)をWSE-7040 EzApply DNAと混合後、15%のポリアクリルアミドゲル(EHR-T15L)を使用して、分離した結果を示しています。泳動バッファーには WSE-7066 EzRun MOPS non-SDS (左)あるいはWSE-7055 EzRun TG(右)を使用しました。また泳動後のゲルの染色はWSE-7130 EzFluoroStain DNAを使用し、CyanoViewで励起してWSE-5400 Printgraph Classicで撮影しました。
このようにWSE-7066 EzRun MOPS non-SDSは10~20 bpのDNA断片が分子量に応じた移動度で分離され、1 bpの違いも明瞭に分離できることが示されました。従来のWSE-7055 EzRun TG では、若干の差はありますがほぼ同じ位置にバンドが分離されます。通常の既製ゲルを使用し、バッファーをWSE-7066 EzRun MOPS non-SDSに変更すれば、尿素などで変性することなく、簡便に DNA断片の泳動を実現できることが示されています。
EzRun MOPS non-SDSによるタンパク質のNative PAGE
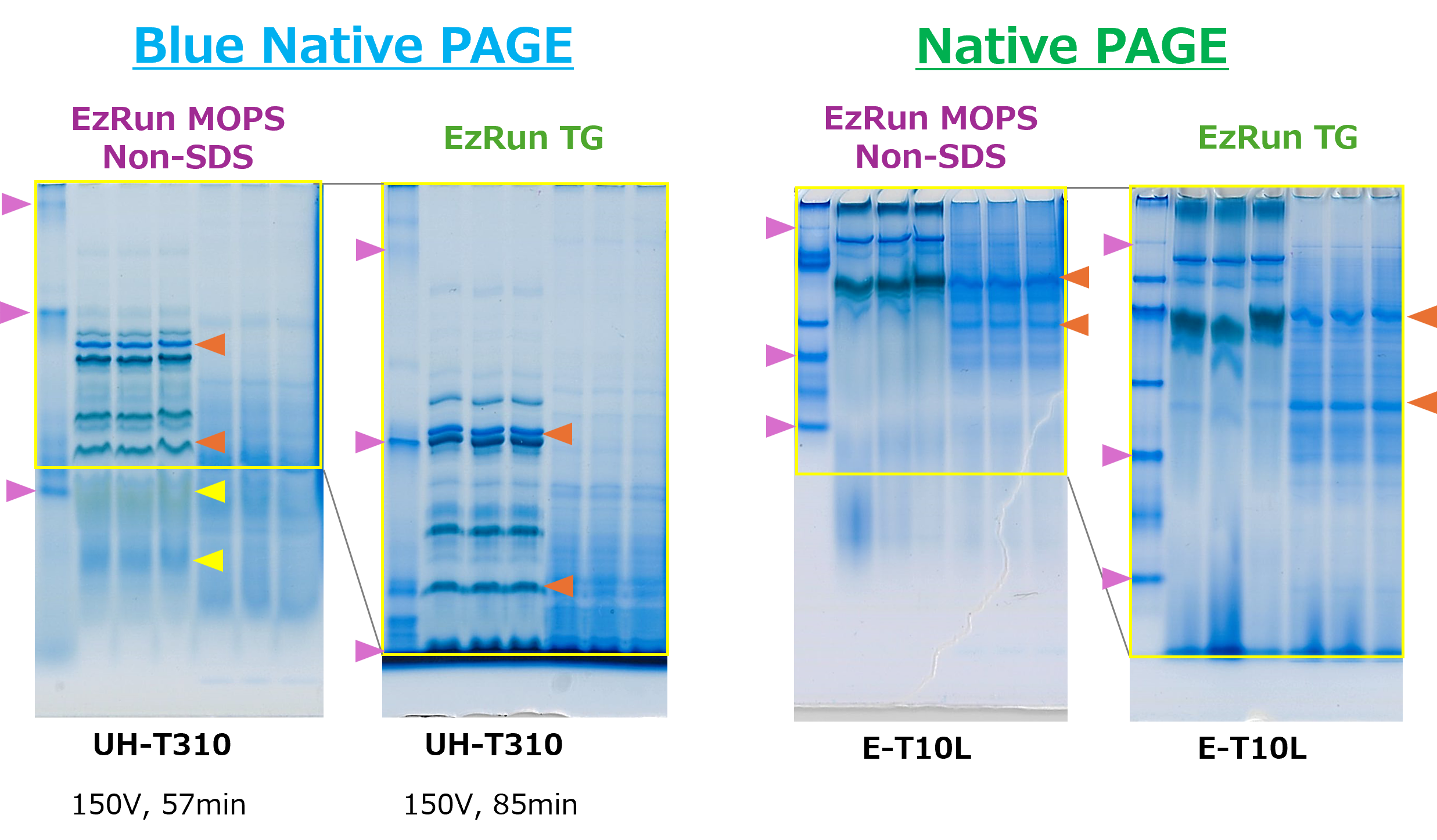
レーン1:EzStandard Native
レーン2-4:葉緑体抽出液
レーン5-7:大腸菌抽出液
上図は、葉緑体由来タンパク質を WSE-7424 EzProteoLysis Native、大腸菌由来タンパク質を WSE-7423 EzBactYeast Crusher を用いて抽出し、WSE-7011 EzApply Native と混合後、ただちに既製ゲル(u-PAGEL H 3-10%ゲルおよびe-PAGEL 10%ゲル)を使用し、Blue Native PAGE(左)、Native PAGE(右)で分離した結果を示しています。泳動バッファーには WSE-7066 EzRun MOPS non-SDS (左)あるいはWSE-7055 EzRun TG(右) を使用し、Blue Native PAGEの陰極バッファーにのみ WSE-7067 EzBlueNative Additive を1/100容量添加しました。
このようにWSE-7066 EzRun MOPS non-SDSはWSE-7055 EzRun TG よりも移動度が小さくなることが示されました。またWSE-7067 EzBlueNative Additive を添加するだけで、簡便に Blue Native PAGE を実現でき、Native PAGEでも明瞭にバンドを分離できることがわかります。
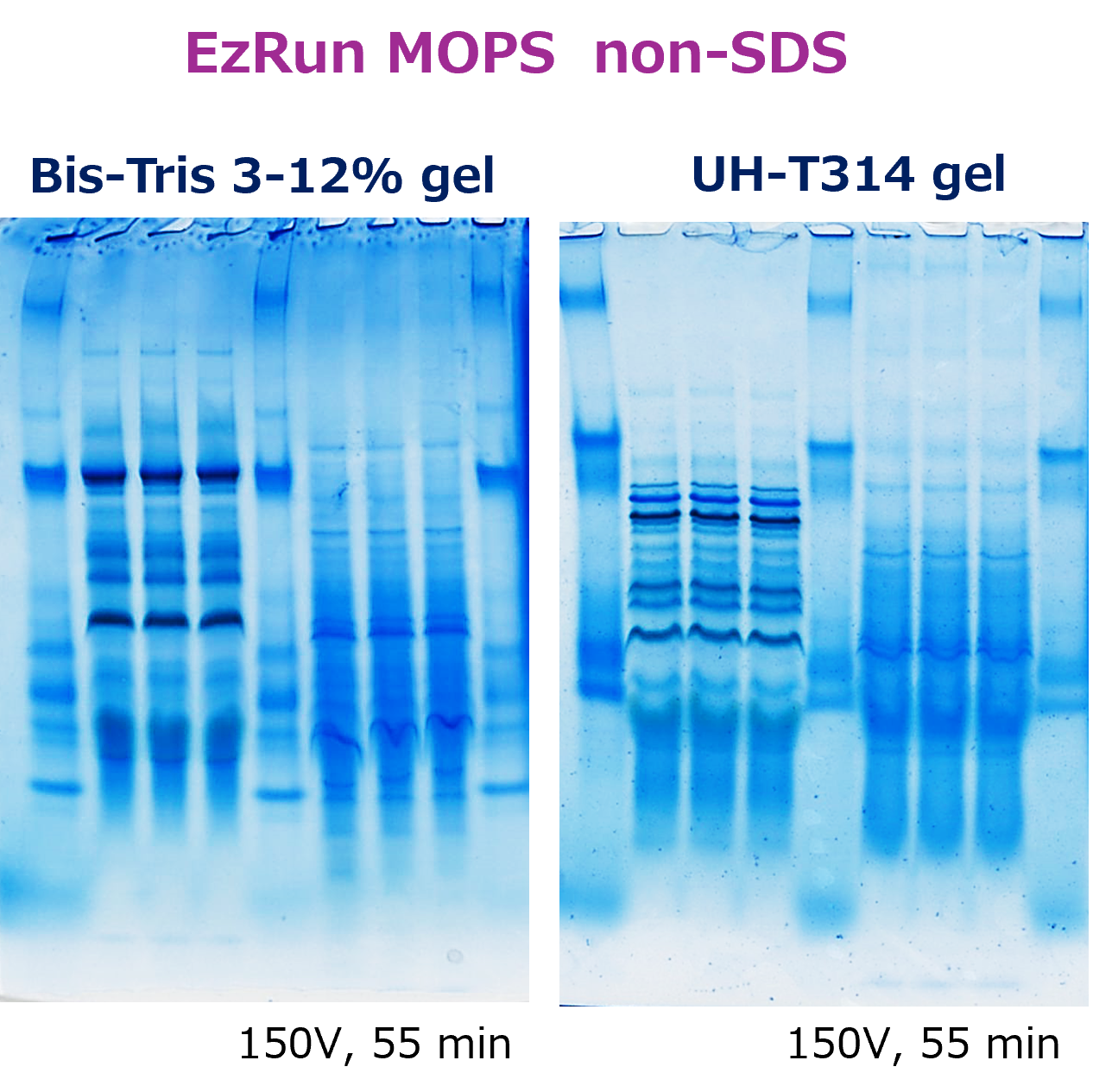
EzRun MOPS non-SDSによるBis-TrisゲルのBlue Native PAGE

左図は、葉緑体由来タンパク質を WSE-7424 EzProteoLysis Native、大腸菌由来タンパク質を WSE-7423 EzBactYeast Crusher を用いて抽出し、WSE-7011 EzApply Native と混合後、ただちに既製ゲル(他社製 Bis-Tris 3-12% ゲル および アトー製 u-PAGEL H 3-14%ゲル)で分離した結果を示しています。泳動バッファーには WSE-7066 EzRun MOPS non-SDSを使用し、 陰極バッファーにのみ WSE-7067 EzBlueNative Additive を1/100容量添加しました。
このようにWSE-7066 EzRun MOPS non-SDSはTris/Tris-Glycine系ゲルだけではなく、Bis-Tris系ゲルでも泳動が阻害されることなく使用することができます。さらに WSE-7067 EzBlueNative Additive を添加すれば、簡便に Blue Native PAGE を実現できることが示されています。
ATTO Native系泳動バッファーの特長
| WSE-7056 EzRun ClearNative |
WSE-7057 EzRun BlueNative |
WSE-7055 EzRun TG |
WSE-7066 EzRun MOPS non-SDS |
|
|---|---|---|---|---|
| タンパク質 の電気泳動 |
タンパク質のHR-CN-PAGE用の泳動バッファーとして使用可能です。 | タンパク質のBN-PAGE用の泳動バッファーとして使用可能です。 | タンパク質のNative PAGE用の泳動バッファーとして使用可能です。 | タンパク質のNative PAGEおよびBN-PAGE用の泳動バッファーとして使用可能です。 (BN-PAGEにはEzBlueNative additiveが別途必要になります。) |
| DNA の電気泳動 |
使用できません。 | 使用できません。 | Tris/Gly系既製ゲル Pagelシリーズ:泳動用バッファーとして使用可能です。 アガロースゲル:使用できません。 |
Tris/Gly系既製ゲル Pagelシリーズ:泳動用バッファーとして使用可能です。 自作アクリルアミドゲル:泳動バッファーとして使用可能です。ゲル作製用バッファーとしては使用できません。 アガロースゲル:ゲル作製用バッファー、および泳動用バッファーとして使用可能です。 |
| 使用可能ゲル | Tris系、Tris/Gly系ポリアクリルアミドゲル、cp/p-PAGEL以外のPagelシリーズ | Tris系、Tris/Gly系ポリアクリルアミドゲル、cp/p-PAGEL以外のPagelシリーズ | Tris系、Tris/Gly系ポリアクリルアミドゲル、cp/p-PAGEL以外のPagelシリーズ | Tris系、Tris/Gly系、Bis-Tris系、イミダゾ-ル系ポリアクリルアミドゲル、cp/p-PAGEL以外のPagelシリーズ、アガロースゲル |
| 特徴など | 泳動バッファーに含まれる陰イオン性界面活性剤のミセルがタンパク質に結合することで、溶解度が上がり、コンプレックス全体が負に帯電し、等電点に関係なく分子量に従った泳動分離ができます。BN-PAGEよりもバンドの分離能が高いといわれています。 | 負に帯電したCBBが大量にタンパク質に結合することで、溶解度が上がり、コンプレックス全体が負に帯電し、等電点に関係なく泳動分離ができます。CBBが結合した疎水性タンパク質は凝集を生じず、界面活性剤による解離も生じないため安定です。逆にCBBが結合しない塩基性の水溶性タンパク質は分離できません。 | タンパク質の電荷および等電点に強く依存します。負に帯電したタンパク質(pIがゲル内の環境より低い、酸性タンパク質)は陽極側に移動し、正に帯電したタンパク質(pIがゲル内の環境より高い、塩基性タンパク質)は陰極側に移動し、消失する場合があります。泳動途中で析出することもあり、スメアなパターンになります。 | タンパク質およびDNAのネイティブ電気泳動に使用できます。ポリアクリルアミド電気泳動では、タンパク質、DNAともにバンドの移動度が大きくなり、低分子バンドがより明瞭に分離できます。特に通常は難しい10~20 bpのDNA断片が15%ゲルでも明瞭に分離可能です。 |
| 泳動バッファー/ゲルの色 | 透明 | CBB由来の濃青色 | 透明 | 透明 |
| 酵素活性の検出 In-gel catalytic activity assay |
タンパク質の変性が最小限に抑えられているため、酵素活性が保持されます。In-gel catalytic activity assayに適しており、OXPHOS、ATP合成酵素、NADPH、HRP、その他さまざまな活性測定に利用されています。 | CBBの結合により酵素活性が阻害されることがあり、ゲルやタンパク質の着色によっても酵素活性の検出が妨げられることがあります。 | タンパク質の変性が生じないため酵素活性が保持されてます。In-gel catalytic activity assayに適しております。ただし泳動中に析出や逆走することがあり、バンドとして分離できないことがあります。 | タンパク質の変性が生じないため酵素活性が保持されてます。In-gel catalytic activity assayに使用可能です。 |
| ◎ | △ | 〇 | 〇 | |
| 蛍光タンパク質の検出 In-gel fluorescence assay |
タンパク質の変性が最小限に抑えられているため、蛍光反応が阻害されず、透明なため蛍光の吸収も生じません。In-gel fluorescence assayに適しており、Cy-Dye標識タンパク質、GFP、YFPなどの解析に利用されています。 | CBBがタンパク質に結合するため蛍光検出が阻害されることがあります。ゲルやタンパク質が濃青色に着色されるため、吸収により蛍光検出が妨げられます。90-95%クエンチングされるといわれています。 | タンパク質の変性が最小限に抑えられているため、蛍光反応が阻害されず、透明なため蛍光の吸収も生じません。ただし泳動中に析出や逆走することがあり、バンドとして分離できないことがあります。 | タンパク質の変性が最小限に抑えられているため、蛍光反応が阻害されず、透明なため蛍光の吸収も生じません。 |
| ◎ | △ | 〇 | 〇 | |
| コンプレックスの構造 | 陰イオン性界面活性剤が少量とはいえ含まれるため、泳動中に、不安定な結合のサブユニットが解離することがあります。そのためコンプレックスを完全な大きさで分離できないことがあります。 | 泳動中にコンプレックスの解離が生じないため、少量で簡便にコンプレックスが分離できます。クロマトグラフィーとの相関性が90%以上と高く、OXPHOS、ATP合成酵素、GPCR、膜タンパク質、その他コンプレックスに利用されています。 | 泳動中にコンプレックスの解離が生じないが、泳動中に析出や逆走することがあり、バンドとして分離できないことがあります。 | 泳動中にコンプレックスの解離が生じないが、高分子よりも低分子の分離に適しています。 |
| △ | ◎ | △ | △ |
ATTO 泳動バッファー セレクションガイド
| 用途 | 泳動バッファー | ゲル バッファー |
使用可能ゲル | 特徴など | |||||
|---|---|---|---|---|---|---|---|---|---|
| 分離対象 | Protein | DNA | DNA | ||||||
| 泳動方法 | SDS -PAGE |
Native -PAGE |
DNA -PAGE |
DNA -PAGE |
自作PAG | アトーの既製ゲル | アガロース ゲル |
||
| AE-1411 | EzRun | 〇 | - | - | - |
〇 Tris系、Tris/Gly系ポリアクリルアミドゲル |
〇 e-PAGEL, e-PAGEL HR, u-PAGEL H, c-PAGEL Neo |
- | Laemmli法に準拠したもっとも一般的なTris/Glycine/SDS 泳動バッファー。 低コスト、粉末なので保存期間が長い。 |
| AE-1412 | EzRun C+ | 〇 | - | - | - |
〇 Tris系、Tris/Gly系ポリアクリルアミドゲル |
〇 e-PAGEL, e-PAGEL HR, u-PAGEL H, c-PAGEL Neo |
- | 還元剤が添加されており、泳動中の再酸化によるブロードバンドの出現を抑え、シャープに分離可能。 粉末。 |
| AE-1415 | EzRun T | 〇 | - | - | - |
〇 Tricine系ポリアクリルアミドゲル |
〇 p-PAGEL, cp-PAGEL Neo |
- | ペプチドなどを分離するTricine PAGE用のTris/Tricine/SDSバッファー。 |
| WSE-7050 | EzRun TAE | - | - | 〇 | 〇 | 〇 | 主にアガロースゲルでDNAを分離するときに使用するゲルバッファー/泳動バッファー。 | ||
| WSE-7051 | EzRun TBE | - | - | 〇 | 〇 |
〇 TBE系、Tris系、Tris/Gly系ポリアクリルアミドゲル |
〇 e-PAGEL, e-PAGEL HR, u-PAGEL H, c-PAGEL Neo |
〇 | 主にDNAを分離するときに使用するゲルバッファー/泳動バッファー。 アガロースゲル、アクリルアミドゲルの両方に使用可能。 |
| WSE-7055 | EzRun TG | - | 〇 | 〇 | 〇 |
〇 Tris系、Tris/Gly系ポリアクリルアミドゲル |
〇 e-PAGEL, e-PAGEL HR, u-PAGEL H, c-PAGEL Neo |
- | SDS不含のTris/Glycineバッファー。タンパク質とDNAのNative-PAGEによる泳動が可能。WSE-7067 EzBlueNative Additiveの添加によりタンパク質のBN-PAGE可能。 |
| WSE-7056 | EzRun ClearNative | - | 〇 | - | - |
〇 Tris系、Tris/Gly系ポリアクリルアミドゲル |
〇 e-PAGEL, e-PAGEL HR, u-PAGEL H, c-PAGEL Neo |
- | SDS不含のHigh Resolution Clear Native PAGE用の泳動バッファー。陰イオン性界面活性剤を使用し、泳動阻害を最小限に抑えて未変性タンパク質の分離が可能。 |
| WSE-7057 | EzRun BlueNative | - | 〇 | - | - |
〇 Tris系、Tris/Gly系ポリアクリルアミドゲル |
〇 e-PAGEL, e-PAGEL HR, u-PAGEL H, c-PAGEL Neo |
- | SDS不含のBlue Native PAGE用の泳動バッファー。EzRun BlueNative Additive付属。CBBによりコンプレックスを解離することなく、泳動阻害を最小限に抑えて、未変性タンパク質の分離が可能。 |
| WSE-7065 | EzRun MOPS | 〇 | - | - | - |
〇 Bis-Tris系、Imidazole系、Tris系、Tris/Gly系ポリアクリルアミドゲル |
〇 e-PAGEL, e-PAGEL HR, u-PAGEL H, c-PAGEL Neo |
- | さまざまなPAGに対応したTris/MOPS/SDSバッファー。タンパク質の移動度が小さくなり、低分子領域の分離が向上する。泳動速度が速いため短時間分離が可能になる。 |
| WSE-7066 | EzRun MOPS non-SDS | - | 〇 | 〇 | 〇 |
〇 Bis-Tris系、Imidazole系、Tris系、Tris/Gly系ポリアクリルアミドゲル |
〇 e-PAGEL, e-PAGEL HR, u-PAGEL H, c-PAGEL Neo |
〇 | SDS不含のTris/MOPSバッファー。タンパク質とDNAのNative-PAGEによる泳動が可能。WSE-7067 EzBlueNative Additiveの添加によりタンパク質のBN-PAGE可能 |
製品仕様
| 型式・名称 | WSE-7066 EzRun MOPS non-SDS (イージーランMOPS non-SDS) |
|---|---|
| 主成分 | トリス、MOPS、EDTA |
| 容量 | 250mL (20×濃縮) |
| 使用前の調製 | 蒸留水で20倍に希釈 |
| 使用量 | 220 mL/回・22回分(当社「サブマージ・ミニ泳動装置」使用時) 450 mL/回・11回分(当社「ラピダスミニスラブ電気泳動装置」使用時) |
| 保存期間 | 遮光・室温保存 1年(未開封時) |
サンプル提供
サンプル品のご依頼は下記ボタンのサンプル依頼フォームからどうぞ
資料ダウンロード
各種資料をダウンロードいただけます。